Aufgrund der digitalen Bildgebung ist die Radiologie Vorreiterin in der Nutzung Künstlicher Intelligenz. Gerade in der Onkologie braucht es Mustererkennung im Sinne einer knackscharfen Unterscheidung von Tumor/Nicht-Tumor und es gibt mit bestätigten Diagnosen annotierte Datensets für das Training. In den Hype mit täglichen Meldungen, was KI schon besser kann als jeder Mensch, bringt Radiologin Ramona Woitek gerne Realitätsnähe. Sie unterrichtet im Humanmedizin-Studium der Danube Private University (DPU) in Krems diagnostische Radiologie. Den Studierenden vermittelt sie auch KI-Kompetenzen, weil die Wahl des richtigen Modells im Berufsalltag so wichtig werden wird, wie die Wahl des richtigen Medikaments. Gemeinsam mit Julia Furtner erprobt sie zudem am DPU-Forschungszentrum MIAAI (Medical Image Analysis and AI) in Wiener Neustadt, was KI verspricht – und was sie hält.

Reality-Check bei Automatisierung
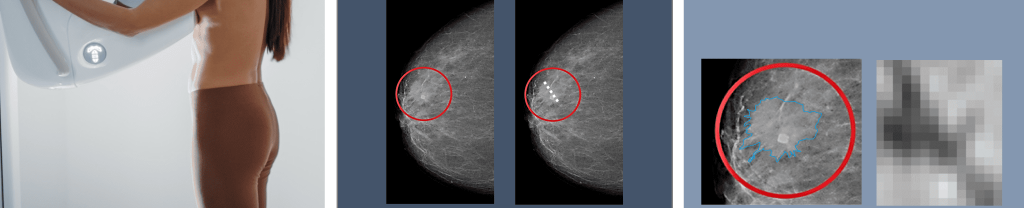
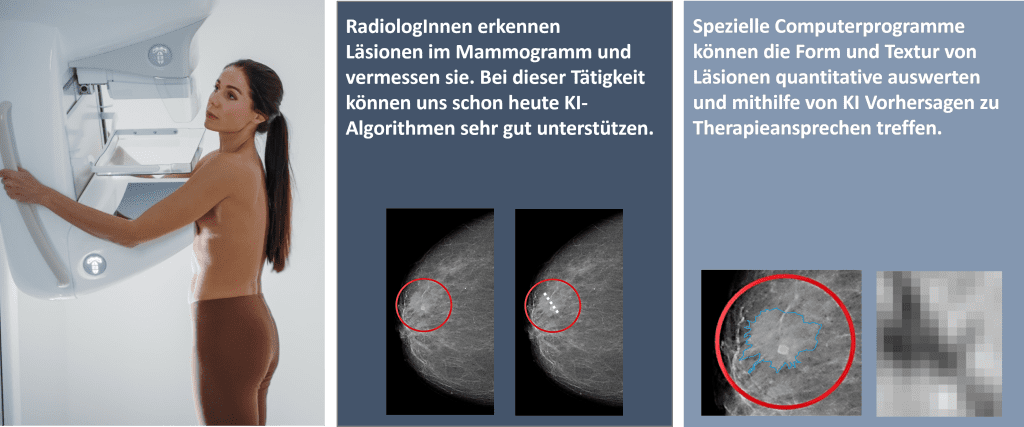
Ramona Woitek hat sich auf onkologische Bildgebung spezialisiert – entscheidend war für sie dabei, dass Brustkrebs häufig ist (eine von acht Frauen erkrankt) und Eierstockkrebs meist spät erkannt wird und daher eine schlechte Prognose hat. Am MIAAI testet sie verschiedene KI-Modelle, um automatisiert Tumore zu erkennen, sie zu klassifizieren, Tumorgröße und -volumen zu bestimmen, Charakteristika aufzuspüren, die mit dem menschlichen Auge nicht erkennbar sind und Vorhersagen zur Therapieansprache bzw. -abfolge zu machen. Denn wenn es in der Vielfalt von Krebserkrankungen einen Grundsatz gibt, so lautet er: Die bestmögliche Tumorbestimmung entscheidet über die bestmögliche individuelle Therapie.
„Es gibt etliche Machine Learning Tools für die Bildanalyse. Sie werden als Medizinprodukt zugelassen und dürfen danach nicht mehr verändert werden. Die Hersteller gehen unterschiedlich offen damit um, welche Daten sie für das Training genutzt haben. Das ist aber wichtig, um die Abweichung bei der Nutzung mit Echtdaten einschätzen zu können.“ In der Praxis summieren sich individuelle Abweichungen von Patient*innen, unterschiedliche Arbeitsweisen von Medizinisch-Technischen Assistent*innen und der Einsatz verschiedener Gerätetypen – noch gar nicht zu reden von verschiedenen Bild-Quellen wie CT oder MRT. Vor dem breiten Einsatz steht daher jedenfalls die Frage: Wie gut passt das Modell mit meinem Patient*innenkollektiv zusammen? Schon an der Basis, bei der Datenqualität öffentlich zugänglicher Trainingssets, gibt es Luft nach oben, so Woitek. Diese sind teilweise „schlampig“ annotiert, also wären Zeit, Mühe und Expertise hier gut investiert. Produktentwickler sind jedenfalls gut beraten, hochqualitative Datensets zu nutzen.
Agent KI, übernehmen Sie?
Für Brust- und Prostata-Screening gibt es gute KI-Produkte, die von der reinen Bildinterpretation bis zur Biopsievorbereitung reichen, also gleich die ideale Stelle für eine Gewebeprobe identifizieren. Über die Krebs-Behandlung entscheiden in der Klinik interdisziplinäre Tumorboards im Team: Sie werten verschiedene Datenquellen (von Blutbefund bis Bilder) der Patient*innen aus und leiten daraus Therapie-Entscheidungen ab. So eine differenzierte, multimodale Entscheidungsvorbereitung klingt nach dem idealen Job für aufgabenorientierte, autonome „agentische KI“, die gerade in aller Munde ist: „Daran arbeiten viele Gruppen, weil es das tägliche Brot in der Krebsbehandlung ist. Das steckt aber noch in den Kinderschuhen. Es ist im Vergleich viel einfacher, hochspezialisierte Modelle zu trainieren.“ Das Training mit homogenen Datensätzen bringt keine KI-Modelle hervor, die auf die unordentliche, vielfältige und komplexe Realität gut vorbereitet sind. „Es würde mich also sehr überraschen, wenn in fünf Jahren ein KI-Agent bereits solche klinischen Entscheidungen unterstützt“, so Woitek.

Mittelfristig verbessern kann sich das Zusammenspiel durch einen parallelen und wechselweise immer wieder überprüften Einsatz von ärztlichen und KI-Analysen bzw. Prognosen, wie er in einzelnen Kliniken bereits durchgeführt wird. Studien haben gezeigt, dass die Tumormarkierung bisher noch am besten funktioniert, wenn Mensch und Maschine zusammenarbeiten. Eine weitere Hoffnung liegt für Ramona Woitek in der Aufrüstung bestehender MRT auf metabolische Bildgebung mit Kohlenstoff-13 als Alternative zu PET-Scans. Hier engagiert sich die Radiologin aktuell in einem großen internationalen Team. Da in Tumorgewebe der zelluläre Stoffwechsel sehr aktiv ist, könnte die Markierung mit C13 trennschärfere Bilder liefern, ohne die Patient*innen mit Strahlung zu belasten. Mehr Einblick, frühe Diagnosen und gute Entscheidungen – das würde vielen Patient*innen wirklich helfen.
Astrid Kuffner